© shotshop
Le traitement de certains types de cancer fait notamment intervenir des inhibiteurs de point de contrôle immunitaire (ICI), tels que les « inhibiteurs PD-1 » (PD-1 signifie « mort programmée 1 », c'est-à-dire la mort programmée de la cellule). Les ICI sont des médicaments immunothérapeutiques capables d'éliminer les mécanismes de freinage naturels du système immunitaire, de façon à déclencher une attaque immunitaire contre les cellules cancéreuses.
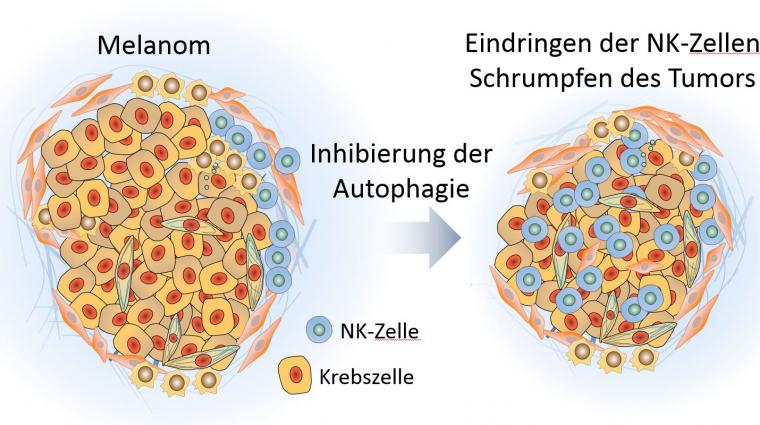
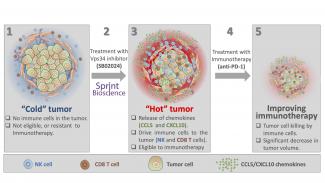
Introduire des cellules immunitaires dans des tumeurs difficiles à infiltrer
Ces médicaments sont très prometteurs pour le traitement de nombreux cancers. Cependant, relativement peu de patients atteints de cancer présentent des bénéfices thérapeutiques significatifs lorsqu'ils sont traités par ICI seul. Par conséquent, il existe un réel besoin clinique de concevoir des thérapies combinatoires qui augmentent les taux de réponse et étendent l'utilisation des ICI à un plus grand nombre de patients et de types de tumeurs différents.
L'une des principales raisons de la réponse inadéquate des tumeurs aux ICI est la migration insuffisante de cellules immunitaires cytotoxiques, c'est-à-dire destructrices de cellules, dans le lit tumoral de ces tumeurs typiquement immuno-résistantes. Les scientifiques parlent dans ce cas de tumeurs « froides ». Les tumeurs « chaudes », c'est-à-dire enflammées, sont attaquées par des cellules immunitaires et réagissent donc à l'immunothérapie. Et par conséquent, les approches qui aident à faire passer des cellules immunitaires dans les tumeurs « froides » mal infiltrables sont cruciales.
Les cellules immunitaires qui tuent les cellules migrent vers le lit tumoral
Dans ce contexte, le groupe de recherche ‘Tumor Immunotherapy and Microenvironment (TIME)’, dirigé par le Dr Bassam Janji, du ‘Department of Oncology’ au Luxembourg Institute of Health (LIH), et la société pharmaceutique suédoise Sprint Bioscience ont conçu une stratégie innovante pour recruter les principales cellules immunitaires cytotoxiques dans le lit tumoral en inhibant l’autophagie. L'autophagie, un processus de «recyclage» cellulaire, a également été associée à l'évasion des cellules cancéreuses à la surveillance immunitaire. Plus précisément, les scientifiques ont exploité plusieurs molécules et techniques, notamment la molécule SB02024 de Sprint Bioscience, qui agissent contre Vps34, une protéine clé impliquée dans le processus d'autophagie.
L'autophagie est un processus de recyclage cellulaire – un genre d'« auto-digestion » – qui permet aux cellules cancéreuses d'absorber des nutriments pour poursuivre leur croissance. Plus précisément, les scientifiques ont utilisé plusieurs molécules et techniques, et notamment la substance principale SB02024 de Sprint Bioscience. Celle-ci agit contre la protéine clé Vps34, impliquée dans l'initiation du processus d'autophagie.
L'inhibition de l'autophagie entraîne une libération accrue de substances messagères
Les chercheurs ont utilisé des modèles précliniques de souris pour évaluer les effets du ciblage génétique et pharmacologique de Vps34 sur la croissance tumorale et la survie des souris. Les scientifiques ont découvert que l'inhibition de l'autophagie provoquait une libération accrue de chimiokines (CCL5 et CXCL10).
Les chimiokines sont des substances messagères qui se forment lorsque le système immunitaire réagit. Dans ce cas, il s’agit de deux chimiokines qui favorisent l'inflammation et qui participent, dans le micro-environnement de la tumeur, au recrutement de cellules immunitaires destructrices de cellules telles que les cellules tueuses naturelles, les macrophages (cellules dévoreuses des globules blancs) et les cellules T (globules blancs qui servent la défense immunitaire).
L'efficacité des médicaments immunothérapeutiques s'est considérablement améliorée
Une telle infiltration était associée à une croissance tumorale réduite et une survie prolongée des souris porteuses de mélanome et de tumeur colorectale. Ces résultats ont mis en évidence le très haut potentiel des inhibiteurs de Vps34 en tant que médicaments rendant les tumeurs éligibles ou sensibles à l'immunothérapie basée sur les ICI. De plus, l'équipe du Dr Janji a montré que la combinaison de l'inhibiteur de Vps34 SB02024 avec les anti-PD-1 améliore considérablement l'efficacité de ces ICI dans le mélanome et le cancer colorectal résistants au traitement.
Sur la base de leurs résultats précliniques, les scientifiques ont également établi une «signature de réponse Vps34». En utilisant cette signature, ils ont pu stratifier 470 patients atteints de mélanome en trois groupes présentant un niveau d'expression élevé, intermédiaire et faible de «signature de réponse Vps34». Ces trois groupes correspondent aux patients présentant respectivement des tumeurs « chaudes », « intermédiaires » et « froides ». L'équipe a montré que la survie globale et sans maladie des patients présentant une « signature de réponse Vps34 » élevée (tumeur « chaude ») est significativement meilleure par rapport à ceux portant une « signature de réponse Vps34 » faible (tumeur froide).
L'approche combinatoire accroît l'utilité thérapeutique des inhibiteurs de PD-1
« Notre étude a mis en évidence le potentiel de l’inhibition de la protéine Vps34, et donc de l’autophagie, en tant qu'approche combinatoire innovante pour étendre le bénéfice thérapeutique des ICI comme les anti-PD-1 aux patients atteints de mélanome et de cancer colorectal ne répondant pas ou n’étant pas éligibles à cette immunothérapie révolutionnaire. De plus, nos résultats fournissent une première preuve de concept pour soutenir la conception d’essais cliniques innovants utilisant des inhibiteurs de Vps34 en combinaison avec les anti-PD-1 », conclut le Dr Janji.
Auteurs : LIH, Uwe Hentschel
Illustration : LIH
Infobox
L'étude, co-écrite par le Dr Bassam Janji et le Dr Guy Berchem, a été publiée le 29 avril 2020 dans la prestigieuse revue Science Advances, avec le titre complet « Inhibition of Vps34 reprograms cold into hot inflamed tumors and improves anti-PD-1/PD-L1 immunotherapy ». Elle a été réalisée en collaboration avec Sprint Bioscience (Suède), le Centre Hospitalier de Luxembourg (CHL), le Karolinska Institute (Suède) et l'Université de Pennsylvanie (USA). L'étude a été financée par des subventions du FNR, du FNRS Télévie, de la Fondation Cancer, de la Foundatioun Kriibskrank Kanner, de Janssen Cilag Pharma, de l’Action LIONS Vaincre le Cancer Luxembourg et de la Fondation Suédoise pour la Recherche Stratégique.